







 Рейтинг: 4.7/5.0 (1641 проголосовавших)
Рейтинг: 4.7/5.0 (1641 проголосовавших)Категория: Инструкции
Болезнь Вильсона (Вильсона-Коновалова) – это редкая наследственная патология, в результате которой излишки меди накапливаются в печени, головном мозге и других жизненно важных органах. Симптомы, как правило, начинают проявляться в возрасте 12-23 лет.
Медь играет ключевую роль в развитии здоровой нервной системы, костей, выработке коллагена и кожного пигмента меланина. При нормальном метаболизме этот элемент поступает в организм с пищей, а излишки выводятся с желчью – веществом, производимым печенью.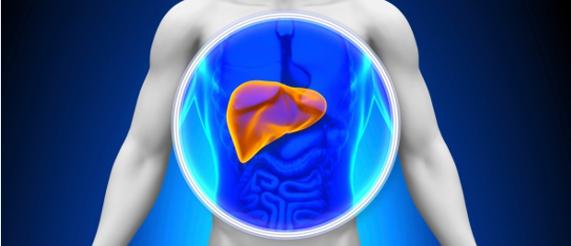
Однако у людей с болезнью Вильсона медь не выводится из организма должным образом и скапливается во внутренних органах, иногда – вплоть до уровня, угрожающего жизни. При условии ранней диагностики это тяжелое заболевание поддается лечению, и многие пациенты с данной патологией ведут обычный образ жизни.
СимптомыДостаточно сложно правильно диагностировать болезнь Вильсона: симптомы этого нарушения очень схожи с признаками других, более распространенных заболеваний. Кроме того, симптоматика может варьироваться в зависимости от того, какой именно орган сильнее всего страдает от накопления меди. Среди наиболее явных признаков патологии числятся следующие:
 При проявлении любых симптомов, вызывающих беспокойство, следует как можно скорее обратиться к врачу. Если у вашего родственника обнаружена болезнь Вильсона, диагностика может понадобиться всем членам семьи.
При проявлении любых симптомов, вызывающих беспокойство, следует как можно скорее обратиться к врачу. Если у вашего родственника обнаружена болезнь Вильсона, диагностика может понадобиться всем членам семьи.
Эта патология входит в число аутосомных рецессивных признаков. Наследственные заболевания этого типа развиваются только в тех случаях, когда ребенок получает два одинаковых дефектных гена - по одному от каждого из родителей. Если у вас обнаружен только один ген с патологией, вы не страдаете заболеванием, однако являетесь его носителем, это означает, что дефектный ген могут унаследовать ваши дети.
Факторы рискаВ группе риска находятся родственники тех, у кого диагностирована гепатоцеребральная дистрофия. Если данным заболеванием страдают ваши родители, братья или сестры, возможно, вам следует пройти генетическое обследование на выявление патологических генов. Ранняя диагностика существенно повышает шансы на успешное излечение.
ОсложненияЗаболевание может повлечь серьезные осложнения. В их числе:
Для постановки точного диагноза и назначения терапии нужно обратиться к специалисту по заболеваниям печени – гепатологу. Однако в том случае, если вы впервые обращаетесь в медицинское учреждение с жалобами на симптомы, схожие с признаками болезни Вильсона, следует начать с посещения терапевта. При необходимости он перенаправит вас к нужному специалисту.
Так как медицинские консультации чаще всего ограничены во времени, а врачи при этом стремятся донести до пациентов максимум материала, лучше подготовиться к визиту заблаговременно. Специалисты дают следующие рекомендации:
Нарушение выведения меди из организма, как и любые другие наследственные заболевания, представляет собой достаточно обширную тему. При этом продолжительность медицинской консультации ограничена, и для получения полного объема интересующей вас информации лучше заблаговременно подготовить перечень вопросов врачу. Перечислите то, что вас больше всего беспокоит, и ранжируйте вопросы по степени важности. Так, в случае подтверждения диагноза "гепатолентикулярная дегенерация" (она же – болезнь Вильсона-Коновалова) необходимо уточнить у специалиста некоторые моменты: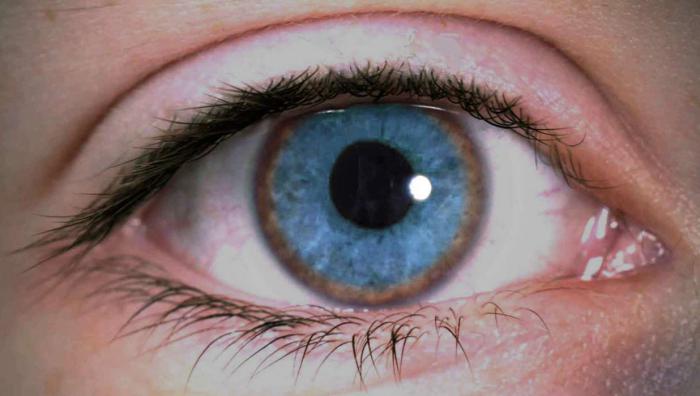
Ни в коем случае не стесняйтесь задавать и другие вопросы, в том числе уточняющие, в случае если вы не поняли что-либо из объяснений врача. Все детали имеют значение, поэтому старайтесь конспектировать ключевую информацию.
ДиагностикаГепатоцеребральная дистрофия представляет собой серьезную проблему в плане диагностики, так как признаки и симптомы этого заболевания характерны для многих других, более распространенных и изученных нарушений функционирования печени (например, гепатита). Более того: многие признаки проявляются постепенно, а с течением времени и вовсе меняют характер или интенсивность. Так, изменения в поведении, которые становятся заметны с возрастом, сложнее всего связать с болезнью Вильсона. Для постановки диагноза врачи опираются одновременно на информацию о симптоматике и на результаты диагностических исследований.
ИсследованияДля диагностики болезни Вильсона применяются следующие методы:
Врач может порекомендовать принятие определенных лекарственных препаратов, способствующих образованию хелатов. Медикаменты этого типа побуждают внутренние органы выпустить излишки меди в кровоток. Она затем фильтруется почками и уходит в мочу. После этого терапия сосредотачивается на предупреждении дальнейшего накопления упомянутого элемента. Если печень серьезно повреждена, может потребоваться пересадка.
МедикаментыЕсли у пациента наблюдается глухота и болезнь Вильсона, среди основных лекарственных препаратов, назначаемых специалистами, обычно числятся:
Многих пациентов интересует неоднозначный вопрос: не вызывает ли вреда накопление цинка в организме, учитывая, что болезнь Вильсона-Коновалова необходимо лечить на протяжении всей жизни?
Специалисты советуют не волноваться: хотя уровень цинка в организме слегка возрастает в самом начале терапии, в дальнейшем метаболизм этого элемента нормализуется. Кроме того, цинк, в отличие от меди, не обладает ненормальной тенденцией накапливаться в тканях внутренних органов. Единственная настоящая опасность, которую представляет собой долгое лечение упомянутым препаратом, аналогична рискам при любой другой терапии болезни Вильсона: это передозировка, которая может повлечь дефицит меди. Такое случается крайне редко, потому что лечащие врачи обязательно следят за уровнями этих двух элементов, отражаемыми в анализах мочи пациента. Если меди станет слишком мало, можно уменьшить дозы ацетата цинка и таким образом предотвратить развитие анемии. Достаточно сдавать анализы раз в год, так как уровни указанных химических элементов долго остаются стабильными.
В начале терапии прием лекарственного препарата способен вызвать расстройство желудка, тошноту и рвоту. Для снижения интенсивности этих побочных эффектов некоторые специалисты рекомендуют принимать утреннюю дозу углекислого цинка одновременно с небольшим кусочком ветчины или колбасы из мяса индейки. Важно не сочетать прием медикамента с употреблением продуктов, богатых простыми и сложными углеводами. Как правило, тошнота и другие побочные эффекты постепенно сходят на нет по мере следования назначенному курсу лечения. В редких случаях даже время не снижает интенсивность тошноты, однако сочетание медикамента с колбасой, как ни странно, помогает практически всем.
Хирургическая операцияПри серьезных повреждениях печени может потребоваться пересадка этого органа. Во время хирургической операции врач извлекает пораженную печень и заменяет ее здоровым органом-трансплантатом. Большинство трансплантатов поставляются от уже умерших доноров. Однако в некоторых случаях принимается решение о пересадке печени от живого человека, например, от близкого родственника. Тогда хирург удаляет поврежденную печень и заменяет ее фрагментом донорского органа.
Самостоятельная борьба с болезньюБолезнь Вильсона у детей и взрослых развивается постепенно, и иногда можно существенно ограничить ее развитие собственными силами. Для этого врачи рекомендуют пересмотреть свой обычный рацион и уменьшить объем меди, потребляемой в виде продуктов питания. Если у вас дома медный водопровод, будет нелишним произвести замеры уровня данного элемента в проточной воде. И, разумеется, следует избегать приема витаминов и биологически активных пищевых добавок, содержащих это вещество.
Особенно богаты медью и потому потенциально опасны следующие продукты питания:
Современное лечение болезни Коновалова-Вильсона
БОЛЕЗНЬ ВИЛЬСОНА - КОНОВАЛОВА (Гепатолентикулярная дегенерация)
Это тяжелое прогрессирующее экстрапирамидное заболевание, постоянным и характерным признаком которого является поражение печени.
Заболевание наследственное, передается по аутосомно-рецессивному типу. С помощью метода рекомбинации ДНК получены данные, свидетельствующие о локализации патологического процесса, ответственного за развитие болезни, на хромосоме 13.
Ведущую роль в патогенезе играет патология обмена меди, вследствие нарушения синтеза фермента церулоплазмина, которые приводят к отложению избыточного количества меди в различных органах и тканях (преимущественно в печени, мозге, почках и роговице) и развитию вследствие этого клинических симптомов болезни.
Поражение печени имеет характер крупноузлового или смешанного (крупноузлового и мелкоузлового) цирроза.
Развитие цирроза печени может проходить через стадию хронического активного гепатита.
В почках медь откладывается главным образом в проксимальных отделах почечных канальцев, что приводит к нарушению реабсорбции целого ряда важных для организма соединений и может сопровождаться определенными метаболическими сдвигами.
В результате отложения меди в десцеметовой мембране роговицы образуется роговичное кольцо Кайзера — Флейшера, которое является патогномоничным признаком болезни.
В мозге медь преимущественно откладывается в базальных ганглиях, главным образом в скорлупе.
Токсическое действие меди является важным фактором, приводящим к развитию морфологических изменений в мозговой ткани.
Этиология и патогенез.
Заболевание наследуется по аутосомно-рецессивному типу.
Ген болезни расположен на длинном плече хромосомы 13, он клонирован и изучен. Ген кодирует переносящую медь-АТФазу, с которой связывается 6 атомов меди. К настоящему времени выявлено более 25 различных мутаций гена. Мутации на каждой из хромосом различны, что затрудняет установление соответствия между фенотипом и генотипом.
Существенно, что у гетерозиготных носителей заболевание не развивается.
Нормальная концентрация меди в плазме крови составляет 100—120 мкг%, причем 93% этого количества находится в виде церулоплазмина и только 7% связано с сывороточными альбуминами.
Медь в церулоплазмине связана прочно.
Связь осуществляется в печени.
Церулоплазмин является b2-глобулином, и каждая его молекула содержит 8 атомов меди.
Радиоизотопными методами установлено, что при гепатолентикулярной недостаточности нарушение связано с генетическим дефектом синтеза церулоплазмина, из-за чего содержание его резко снижено.
При этом медь не может быть стабильно связана и откладывается в тканях.
В некоторых случаях содержание церулоплазмина остается нормальным, но меняется его структура (изменяется отношение фракций). Особенно тропна медь при синдроме Вильсона — Коновалова к печени, ядрам мозга, почкам, эндокринным железам, роговице.
При этом медь начинает действовать как токсический агент, вызывая типичные дегенеративные изменения в этих органах.
Клиническая картина характеризуется разнообразием, что обусловлено повреждающим действием меди на многие ткани.
Преимущественное поражение того или иного органа зависит от возраста. У детей это в основном печень (печеночные формы).
В дальнейшем начинают превалировать неврологическая симптоматика и нарушения психики (нейропсихические формы).
Если заболевание проявляется после 20 лет, то у больного обычно отмечается неврологическая симптоматика.
Возможно сочетание симптомов обеих форм.
У большинства больных в возрасте от 5 до 30 лет уже выражены клинические проявления заболевания и диагноз установлен.
Кольцо Кайзера — Флейшера представляет собой зеленовато-коричневое кольцо по периферии роговицы.
Вначале оно появляется на верхнем полюсе.
Для выявления кольца Кайзера — Флейшера больной, как правило, должен быть осмотрен окулистом с помощью шелевой лампы.
Оно выявляется у больных, имеющих неврологические симптомы, и может отсутствовать у молодых больных с острым началом заболевания.
Течение. Различают острую и хроническую формы.
Острая форма характерна для раннего возраста, развивается молниеносно и кончается летально, несмотря на лечение.
Чаше встречается хроническая форма с медленным течением и постепенным развитием симптоматики.
Раньше всего появляется экстрапирамидальная мышечная ригидность нижних конечностей (нарушение походки и устойчивости).
Постепенно формируется картина паркинсонизма, затем изменяется психика (параноидальные реакции, истерия).
Иногда на первый план выступает печеночная недостаточность: увеличение печени, картина напоминает цирроз или хронический активный гепатит.
Диагностика. Ведущим признаком является гипокупремия ниже 10 мкг%, много меди выделяется с мочой — свыше 100 мкг/сут.
Может быть положительная тимоловая проба.
Важным симптомом является кольцо Кайзера — Флейшера.
Уровни церулоплазмина и меди в сыворотке обычно снижены, КТ черепа, выполненная еще до появления неврологических симптомов, может выявить увеличение желудочков, а также другие изменения.
МРТ обладает большей чувствительностью.
Она может выявить расширение III желудочка, очаги поражения в таламусе, скорлупе и бледном шаре.
Эти поражения обычно соответствуют клиническим проявлениям заболевания.
Генетические исследования (по Ш. Шерлок).
Братья и сестры больного должны быть обследованы.
О гомозиготности свидетельствуют гепатомегалия, спленомегалия, сосудистые звездочки, небольшое повышение активности трансаминаз в сыворотке.
Кольцо Кайзера — Флейшера выявляется не всегда.
Уровень церулоплазмина в сыворотке обычно снижен до 0,20 г/л и менее. Биопсия печени с определением содержания меди позволяет подтвердить диагноз.
Отличить гомозигот от гетерозигот легко, хотя иногда могут возникнуть трудности.
В таких случаях проводят анализ гаплотипов больного и его братьев и сестер.
Гомозигот лечат пеницилламином, даже если заболевание протекает бессимптомно.
Гетерозиготам лечение не требуется.
При наблюдении за 39 клинически здоровыми гомозиготами, получающими лечение, появления симптомов не отмечено, в то же время у нелеченых гомозигот развилась болезнь Вильсона и часть из них умерли.
Использование ДНК-маркеров позволяет с высокой точностью установить диагноз болезни Вильсона.
Однако генетическое исследование имеет значительные ограничения, в числе которых высокая стоимость методики и значительная вариабельность мутаций гена болезни Вильсона.
В настоящее время это исследование проводится у детей, чьи близкие родственники страдают заболеванием, и когда стандартные тесты не дают однозначного ответа, подтверждающего или отрицающего диагноз болезни Вильсона.
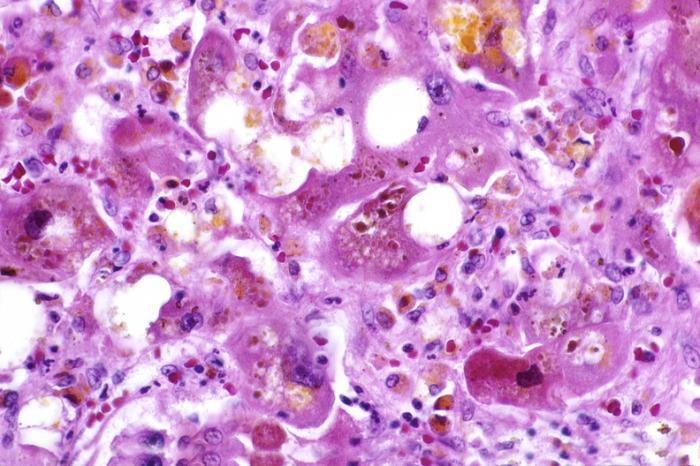
Патоморфология печени. Закономерно выявляется баллонная дистрофия, многоядерность гепатоцитов, скопления гликогена и гликогеновая вакуолизация ядер. Характерна жировая инфильтрация гепатоцитов. Клетки Купфера обычно увеличены в размерах.
У некоторых больных эти изменения особенно ярко выражены; выявляются тельца Мэллори, что напоминает морфологическую картину острого алкогольного гепатита.
У части больных наблюдаются изменения в печени, свойственные ХГ.
Гистологические изменения в печени при болезни Вильсона не являются диагностическими, однако выявление описанных выше изменений у молодых больных с циррозом печени позволяет заподозрить это заболевание.
Метод выявления меди окрашиванием рубеановой кислотой или родамином ненадежен, поскольку медь распределяется неравномерно и в узлах регенерации отсутствует.
Накопление меди обычно происходит в перипортальных гепатоцитах и сопровождается появлением атипичных отложений липофусцина.
Возможно определение содержания меди в печени.
Нормальное содержание меди в ткани печени 15—55 мкг на 1 г сухого вещества ткани печени.
У пациентов с болезнью Вильсона эти значения увеличены и колеблются от 250 до 3000 мкг/г.
Электронная микроскопия. Даже при бессимптомном течении заболевания выявляют аутофагические вакуоли и крупные измененные митохондрии. Жировая инфильтрация может быть связана с повреждением митохондрий. Можно видеть инфильтрацию межклеточного пространства волокнами коллагена, а также светлые и темные клетки печени.
Дифференциальную диагностику проводят с острым и хроническим гепатитом, при котором уровень церулоплазмина может быть снижен из-за нарушения его синтеза в печени.
Недоедание также способствует снижению уровня церулоплазмина.
При приеме эстрогенов, пероральных контрацептивов, при обструкции желчных путей, при беременности уровень церулоплазмина может повышаться.
Суточная экскреция меди при болезни Вильсона повышена.
Во избежание искажения результатов анализа рекомендуется собирать мочу в специальные бутылки с широким горлом с пакетами-вкладышами одноразового пользования, не содержащими медь.
При наличии противопоказаний к биопсии печени при нормальном уровне церулоплазмина в сыворотке заболевание можно диагностировать по степени включения в церулоплазмин перорально принимаемой радиоактивной меди.
Лечение. Требуется диета с исключением продуктов, содержащих большее количество меди (шоколад, какао, горох, печень, ржаной хлеб).
Лекарственная терапия проводится на протяжении всей жизни с момента устаноаления диагноза или обнаружения гомозиготного носительства дефектного гена и является залогом увеличения выживаемости. Необоснованное прекращение лечения может привести к необратимым изменениям и летальному исходу.
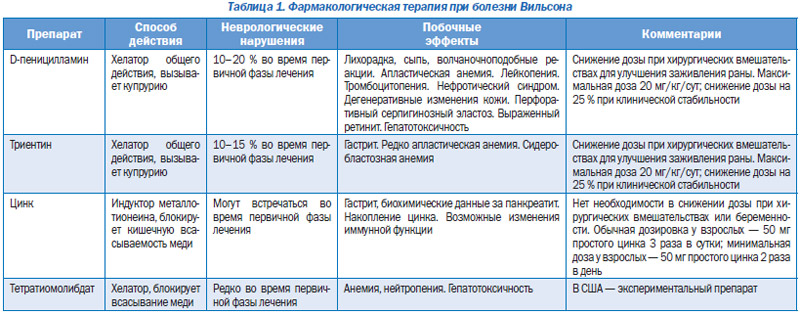
Препарат выбора — D-пеницилламин. До сих пор он остается средством выбора и «золотым стандартом» в лечении болезни Вильсона.
Механизмы действия D-пеницилламина: образование хелатных комплексов с медью, которые выделяются с мочой, и перевод внутриклеточной меди в неактивное состояние.
Препарат рекомендуется принимать натощак (за 30 мин до еды), так как пиша уменьшает его абсорбцию.
Учитывая, что D-пеницилламин дает антипиридоксиновый эффект, к терапии необходимо добавлять пиридоксин в дозе 25 мг/л внутрь.
Схема лечения:
Первый этап — начальная фаза лечения.
Начальная доза D-пеницилламина составляет 250—500 мг/сут, ее делят на 4 приема.
Затем дозу постепенно увеличивают до 1-2 г/сут (каждые 7 дней на 250 мг), пока экскреция меди с мочой не повысится до 2000—5000 мкг/сут.
После достижения клинического улучшения, которое наступает через несколько месяцев от начала лечения, и снижения экскреции меди с мочой переходят на поддерживающую терапию.
В течение двух первых месяцев лечения клинический анализ крови (количество форменных элементов) и мочи (величина протеинурии) проводят каждые 2 нед, в течение следующих 6 мес — ежемесячно.
Второй этап — поддерживающая терапия. Поддерживающие дозы составляют 0,75-1,25 г/сут. Экскреция меди с мочой уменьшается до 500— 1000 мкг/сут.
Ежегодно проводится исследование колец Кайзера - Флейшера в щелевой лампе.
При адекватном лечении происходит уменьшение выраженности и полное исчезновение симптома у 80% больных через 3—5 лет после начала лечения.
Побочные эффекты при лечении D-пеницилламином делятся на ранние, являющиеся в начальной фазе лечения, и поздние, развивающиеся во время поддерживающей терапии.
Ранние побочные эффекты. В течение первого месяца терапии у 20% больных наблюдается появление или ухудшение неврологической симптоматики. Это связано с мобилизацией меди из печени, повышением ее концентрации в ЦНС.
В этой ситуации необходимо снизить дозу до 250 мг/сут и постепенно повышать ее до увеличения экскреции меди с мочой.
Если неврологическая симптоматика продолжает ухудшаться, то D-пеницилламин заменяют другим медь-хелатирующим препаратом (см. ниже).
Ухудшение неврологической симптоматики в первые месяцы лечения необходимо дифференцировать с прогрессированием самого заболевания при применении низких доз D-пеницилламина.
В течение первого месяца лечения у 20% больных развиваются реакции гиперчувствительности — лихорадка, кожный зуд, сыпь и — редко — лимфаденопатия.
Эти симптомы проходят после временной отмены препарата.
Терапию D-пеницилламином возобновляют в дозе 250 мг/сут в комбинации с преднизолоном в дозе 20—30 мг/сут.
В течение месяца дозу D-пеницилламина увеличивают, постепенно отменяя преднизолон.
Поздние побочные эффекты. Развиваются у 5-7% пациентов и обычно манифестируют после года лечения. Наиболее частыми из них являются кожные изменения: пеницилламиновая дерматопатия, пемфигус, acantosis nigricans, elastosis perforans serpinginosa, lichen planus.
У 3-5% больных развиваются синдромы, сходные с аутоиммунными заболеваниями: синдромом Гудпасчера, системной красной волчанкой, миастенией.
При развитии этих осложнений, а также при появлении значительной протеинурии (более I г/сут) D-пеницилламин отменяют и назначают триентин.
Триентин. Используется с 1969 г. как альтернативный медьхелатирующий агент у пациентов, интолерантных к D-пеницилламину.
При переходе на триентин большинство побочных эффектов D-пеницилламина исчезает.
Дозы триентина составляют 1—2 г в день, разделенных на 3 приема. Препарат принимают натощак.
Наиболее тяжелым побочным эффектом является сидеробластная анемия.
Цинк. Использование цинка при болезни Вильсона основано на его способности увеличивать синтез медьсвязывающих белков в эпителии тонкой кишки и в гепатоцитах.
Это препятствует абсорбции меди из ЖКТ и обеспечивает перевод меди в нетоксичное состояние. Ежедневные дозы сульфата или ацетата цинка составляют 150 мг в день, разделенных на два-три приема.
Препарат назначают между приемами пищи.
Цинк относительно безопасен, из побочных эффектов наиболее частыми являются расстройства со стороны ЖКТ и головная боль.
Целесообразно использование цинка у асимптомных больных на ранних стадиях заболевания и в качестве поддерживающей терапии у пациентов, которым предварительно проводилась терапия медьхелатирующими препаратами.
Одновременное назначение хелаторов меди и препаратов цинка не рекомендуется.
Тетратиомолибдат. Механизмами действия этого препарата являются: образование комплексов с медью в ЖКТ и сыворотке крови, что препятствует соответственно ее абсорбции и проникновению в ткани. Рассматривается как потенциально более эффективный хелатор меди, чем D-пеницилламин и триентин.
В настоящее время имеются только ограниченные данные о клиническом использовании этого препарата.
Суточная доза составляет 120—200 мг. В качестве побочных эффектов описано угнетение костномозгового кроветворения.
Лечение хелаторами меди во время беременности не должно прекращаться. Рекомендуемые дозы D-пеницилламина, составляющие 0,75—1 г/сут, не представляют риска для плода.
Если планируется кесарево сечение, то за 6 нед до родоразрешения и на весь срок до заживания послеоперационной раны дозу D-пеницилламина необходимо снизить до 250 мг/сут.
Показаниями к трансплантации печени при болезни Вильсона являются: печеночная недостаточность, ассоциированная с гемолизом и гиперурикемней; прогрессирование печеночной недостаточности, не поддающейся медикаментозной коррекции.
Показатели однолетней выживаемости после трансплантации составляют около 80%.
Генная терапия.
В последние годы обсуждается вопрос о возможности замещения в печени дефектного гена болезни Вильсона нормальным.
Однако ввиду значительных технических трудностей этот вопрос является пока предметом дискуссии.

Результаты первого в истории общеевропейского ретроспективного анализа, представленного на Международном конгрессе по заболеваниям печени, показали, что Д-пеницилламин и триентин по-прежнему остаются эффективными методами лечения, обеспечивая положительный коэффициент выживаемости у пациентов с болезнью Вильсона без пересадки печени. Болезнь Вильсона (гепатоцеребральная дистрофия или гепатолентикулярная дегенерация) является редким генетическим нарушением, при котором из организма не выводится медь, что приводит к ее избыточному скоплению, печеночной недостаточности и повреждению мозга (неврологические проблемы). В мире от этого заболевания страдают примерно 30 000 человек. Если болезнь Вильсона не лечить, она может нанести серьезный вред организму и даже угрожать жизни пациента. Хотя современные медицинские стандарты рекомендуют использовать хелатирующие агенты (Д-пеницилламин, триентин) в качестве терапии первой линии, однако, оптимальные схемы лечения еще окончательно не установлены.
Это ретроспективное групповое исследование изучило отдаленные результаты лечения Д-пеницилламином и триентином 347 пациентов с болезнью Вильсона. Из-за изменений в приеме лекарственных препаратов в общей сложности было проанализировано 467 схем лечения (Д-пеницилламином – 326, триентином – 141). В среднем, спустя 16,5 лет обе схемы лечения показали схожие высокие коэффициенты выживаемости и предотвратили прогрессирование заболевания с необходимостью трансплантации печени у 98% пациентов.
Даниэль Прати, член Научного комитета Европейской ассоциации изучения печени, отметил: «Дело не только в том, что это исследование доказало эффективность обеих схем лечения для пациентов с этим редким и очень изнуряющим заболеванием. Отрадно видеть, что ученые из разных стран Европы могут работать вместе и обмениваться данными, являющимися чрезвычайно ценными для выработки эффективных методов лечения и оценки существующих схем. Изучение редких заболеваний печени представляет для нас большой интерес».
«На сегодняшний день на рынке представлено ограниченное число препаратов для лечения таких заболеваний, в результате чего большинство редких заболеваний остается без эффективного лечения. Мы настоятельно рекомендуем поддерживать исследования редких заболеваний и разработку возможных способов их лечения».
Последующие наблюдения в течение 48 месяцев показали, что ухудшение состояния печени произошло только при 8 схемах лечения из 515 (4 при лечении Д-пеницилламином и столько же – при лечении триентином), в то время как неврологические ухудшения реже встречались в группе, где лечение проводилось Д-пеницилламином (7 из 326), по сравнению с группой, которую лечили триентином (12 из 141). Улучшения функции печени у симптоматических пациентов были схожи в обеих группах, при этом показатели улучшения во время терапии первой линии у симптоматических пациентов достигли 90,7% при использовании Д-пеницилламина и 92,6% – при лечении триентином.
 Триентин (англ. trientine ) — орфанный препарат для лечения болезни Вильсона-Коновалова. Допущен к применению в США под торговым наименование Syprine. В России разрешения на использование в клинической практике не имеет.
Триентин (англ. trientine ) — орфанный препарат для лечения болезни Вильсона-Коновалова. Допущен к применению в США под торговым наименование Syprine. В России разрешения на использование в клинической практике не имеет.
Гепатоцеребральная дистрофия, или болезнь Вильсона-Коновалова — редкое генетическое заболевание с аутосомнорецессивным типом наследования, в основе которого лежит нарушение обмена меди с избыточным её накоплением преимущественно в печени и центральной нервной системе.
По данным НИИ молекулярной биологии и биофизики СО РАН носителями гена, отвечающего за возникновение заболевания, является 1% россиян. Носительство далеко не всегда приводит к возникновению заболевания, однако в семье, где оба родителя являются обладателями мутировавшего гена, велик риск рождения больного ребенка. При развитии болезни Вильсона-Коновалова может быть поражена печень, что приводит к её циррозу, или мозг, тогда пациент оказывается не в состоянии управлять своими движениями и мимикой. Могут развиться и эпилептические припадки.
Основу современного лечения болезни Вильсона-Коновалова является приём D-пеницилламина, образующего с медью хелатные комплексы.
Без лечения болезнь Вильсона-Коновалова является прогрессирующим и фатальным заболеванием. Смерть наступает преимущественно в молодом возрасте, как правило, от осложнений цирроза печени или фульминантного гепатита, реже — от осложнений, связанных с поражением центральной нервной системы. Применение медь-элеминирующей терапии драматически изменило прогноз заболевания. Своевременно начатое лечение возвращает большинство больных к полноценной жизни, полностью восстанавливает работоспособность, репродуктивную функцию у женщин (Т.Н. Лопаткина ).
Показания к применению триентинаТриентин показан для лечения пациентов с болезнью Вильсона-Коновалова у которых имеется непереносимость пеницилламина.
Порядок приёма триентинаТриентин имеет категорию риска для плода при применении препарата беременными по FDA «C» (исследования на животных выявили отрицательное воздействие лекарства на плод, а надлежащих исследований у беременных женщин не было, однако потенциальная польза, связанная с применением данного лекарства у беременных, может оправдывать его использование, несмотря на имеющийся риск).
Данные об опасностях для здоровья младенцев при кормлении их грудью и при терапии матери триентином отсутствуют.
Исследования о воздействии триентина на детей не проводились. Триентин применяется для лечения детей с шестилетнего возраста, данных о неблагоприятном воздействии на их здоровье нет.
Триентин — международное непатентованное наименование (МНН) лекарственного средства. Триентин в 2017 году включают в АТХ. в группу «A16 Прочие препараты для лечения заболеваний ЖКТ и нарушения обмена веществ », в подгруппу «A16AX Различные прочие препараты для лечения заболеваний ЖКТ и обмена веществ» и ему присваивается код A16AX12.
Триентин — рецептурный (Rx ) препарат.
Описание препарата Syprine (на английском, pdf): «Syprine ® (Trientine Hydrochloride). Capsules ». Valeant Pharmaceuticals North America LLC.
Триентин имеет противопоказания, побочные действия и особенности применения, необходима консультация со специалистом.
СУЩЕСТВУЮТ ОГРАНИЧЕНИЯ НА ИМПОРТ/ЭКСПОРТ ДАННОГО ОБРАЗЦА.
Для получения более подробной информации, пожалуйста, свяжитесь с менеджером отдела продаж по телефону +7 (495) 669 30 54 или по электронной почте info@deltaorigin.com
ОписаниеСтандартный образец Trientine Hydrochloride полностью удовлетворяет требованиям ISO (разделы с 30 по 35 в части сертифицированных стандартных образцов) и требованиям качества при проведении исследований, контроля качества, фармацевтической экспертизы, выборочного контроля наряду со стандартами Фармакопеи США (USP), European Pharmacopoeia (EDQM, EP), Британской Фармакопеи (BP), Украинской Фармакопеи (ФСО ГФУ). Поставщики стандартных образцов сертифицированы в соответствии с cGMP, ISO 17025, ISO раздел 34.
Характеристики© ООО "Дельта Ориджин". Все права защищены.
Любое использование материалов сайта разрешено только с согласия Дельта Ориджин. Несогласованное копирование или использование материалов сайта запрещено.
3.5.2 Химические свойства; 3.5.3 Фармакокинетика; 3.5.4 Применение; 3.5. 5 Побочные эффекты. 3.6 Триентин; 3.7 Дефероксамин.
Соли железа, используемые для лечения железодефицитной анемии, — распространенная причина отравлений у детей младшего возраста. Отравление железом рассматривается в статье приведены общие сведения о деферокс-амине. В связи с крупномасштабной добычей радиоактивных тяжелых металлов и их широким использованием в атомной энергетике, производстве ядерного оружия, научных исследованиях и медицинской диагностике случайные отравления этими веществами представляют серьезную опасность. Токсическое действие радиоактивных металлов почти полностью обусловлено ионизирующим излучением, поэтому цель лечения состоит не только в связывании этих металлов комплексобразующими средствами, но и в скорейшем и как можно более полном удалении радиоактивных веществ из организма. Острую лучевую болезнь лечат главным образом симптоматически. Попытки использовать органические восстановители (например, меркаптамин) для предотвращения образования свободных радикалов особого успеха не имели. При авариях ядерных реакторов и использовании ядерного оружия образуются в основном изотопы 239Pu, l37Cs, 144Се и 90Sr. Изотопы стронция и радия с трудом удаляются из организма с помощью комплексобразующих средств. Тому есть несколько причин. Во-первых, эти металлы обладают низким сродством к комплексобразующим средствам. Во-вторых, стронций и радий, откладываясь в костях, разрушают близлежащие капилляры. В результате нарушается кровоснабжение костей, и радиоактивные металлы не выводятся из них. Предпринимались попытки использовать разные комплексобразуюшие средства. Кальциево-тринатриевая сольдиэтилентриаминпентауксусной кислоты — ДТПА (см. ниже) — оказалась эффективной при отравлении M9Pu (Jones et al. 1986). Применение этого препарата вдозе 1 г в/в медленно 3 раза в неделю через день усиливает выведение некоторых радиоактивных металлов у животных и человека в 50—100 раз. Как и при отравлении нерадиоактивными тяжелыми металлами, с увеличением времени, прошедшего после контакта с радиоактивным металлом, эффективность лечения быстро падает. ЭДТА (этилендиаминтетрауксусную кислоту), ее динатриевую соль и другие родственные соединения уже много лет используют в промышленности и науке, поскольку эти вещества образуют хелатные комплексы со многими двух- и трехвалентными металлами. Побочное действие водорастворимых солей ЭДТА зависит от того, какой катион их формирует. Так, динатриевая соль ЭДТА вызывает гипокальциемическую тетанию. Однако использовать вместо динатриевой соли ЭДТА кальциево-динатриевую соль можно только при отравлениях теми металлами, которые имеют большее сродство к комплексобра-зующему средству, чем кальций. Фармакологические эффекты кальциево-динатриевой соли ЭДТА вытекают из ее способности образовывать хелатные соединения с двух- и трехвалентными металлами. Металлы (как экзогенные, так и эндогенные) с более высоким, чем у кальция, сродством к препарату образуют с ЭДТА хелатные комплексы, которые мобилизуются из тканей и выводятся. По данным экспериментов на мышах, кальциево-динатриевая соль ЭДТА связывает катионы некоторых эндогенных металлов, включая цинк, марганец и железо (Cantilena and Klaassen, 1982b). Основное показание к ее применению — отравление металлами, в первую очередь — свинцом. При в/м введении кальциево-динатриевая соль ЭДТА хорошо всасывается, но инъекции болезненны, поэтому ее часто применяют в смеси с местным анестетиком или вводят в/в. В последнем случае препарат разводят в 5% глюкозе или физиологическом растворе и вводят путем в/в инфузии. Разведение необходимо для уменьшения риска тромбофлебита. Во избежание нефротоксического действия до начала терапии и во время нее необходимо поддерживать высокий диурез. Однако при свинцовой энцефалопатии и повышенном внутричерепном давлении поступление жидкости ограничивают, поэтому кальциево-динатриевую соль ЭДТА рекомендуется вводить в/м. Эффективность кальциево-динатриевой соли ЭДТА при свинцовом отравлении объясняется способностью свинца вытеснять кальций из хелатных комплексов и доступностью токсичного металла для комплексобразующего средства. Доказательством тому служит усиление мобилизации и экскреции свинца. При отравлении ртутью кальциево-динатриевая соль ЭДТА неэффективна: хотя ртуть и вытесняет кальций из комплекса с ЭДТА in vitro, в организме она недоступна для препарата. Возможно, это обусловлено слишком прочной связью ртути с сульфгидрильными группами эндогенных лигандов или депонированием металла в тканях, в которые ЭДТА не проникает. Кальциево-динатриевая соль ЭДТА мобилизует свинец, содержащийся в костях (Hammond, 1971). По окончании лечения металл из мягких тканей вновь постепенно перераспределяется в кости. В 1980-х гг. в средствах массовой информации появились сведения о том, что ЭДТА уменьшает риск образования атеросклеротических бляшек, связывая находящийся в них кальций, однако подобное использование препарата не обосновано и неэффективно (Guldageret al. 1992; Elihuetal. 1998). Фармакокинетика. В ЖКТ всасывается менее 5% препарата. После в/в введения все вещество находится в плазме; Т1/2 составляет 20—60 мин. В организме кальциево-динатриевая соль ЭДТА присутствует в ионизированной форме, а потому плохо проникает через клеточные мембраны и распределяется преимущественно во внеклеточной жидкости (объем распределения препарата приблизительно равен объему внеклеточной жидкости). Концентрация препарата в СМЖ составляет всего лишь 5% его концентрации в плазме. В течение часа с мочой выводится около 50% препарата, в течение 24 ч — более 95%, поэтому необходимым условием успешного лечения служит нормальная работа почек. Выведение осуществляется только путем клубочковой фильтрации; почечный клиренс кальциево-динатриевой соли ЭДТА у собак соответствует клиренсу инулина. Ни изменение pH мочи, ни изменение скорости тока канальцевой жидкости не влияют на экскрецию препарата. ЭДТА почти не метаболизируется. Быстрое в/в введение динатриевой соли ЭДТА вызывает гипокальциемическую тетанию. При медленной инфузии (со скоростью менее 15 мг/мин) это осложнение обычно не развивается благодаря поступлению кальция из депо. В отличие от динатриевой соли, кальциево-динатриевую соль ЭДТА можно вводить в/в в относительно больших дозах, не опасаясь гипокальцие-мии, поскольку ни концентрация кальция в плазме, ни его общее содержание в организме при этом почти не изменяются. Нефротоксическое действие. Это наиболее опасный из побочных эффектов кальциево-динатриевой соли ЭДТА. Повторное применение препарата в больших дозах вызывает гидропиче-скую дистрофию эпителия проксимальных канальцев и утрату щеточной каемки (Catsch and Harmuth-Hoene, 1979). В дистальных канальцах и клубочках патологические изменения не столь заметны. На ранних стадиях поражение почек обычно обратимо и после отмены препарата быстро проходит. Один из предполагаемых механизмов нефротоксического действия кальциево-динатриевой соли ЭДТА — прохождение через канальцы большого количества хелатных комплексов с металлами за относительно короткий промежуток времени. Часть этих комплексов может диссоциировать из-за конкуренции ЭДТА с биологическими лигандами или изменения pH (внутри клеток либо в просвете канальцев). Другой, более вероятный механизм — взаимодействие комплексобразующего средства с эндогенными металлами в проксимальных канальцах. Прочие побочные эффекты. К менее тяжелым побочным эффектам относятся недомогание, утомляемость и сильная жажда, сопровождаемые внезапным ознобом и лихорадкой. Впоследствии могут появиться сильная миалгия, головная боль в лобной области, снижение аппетита. Иногда наблюдаются тошнота и рвота; изредка возникают учащенное мочеиспускание и императивные позывы на мочеиспускание. Возможны чихание, заложенность носа, слезотечение, глюкозурия, анемия, дерматит напоминающий поражение кожи при авитаминозе В6, преходящее снижение систолического и диастолического АД, увеличение ПВ, а также инверсия зубца Т на ЭКГ. ДТПА (диэтилентриаминпентауксусная кислота), как и ЭДТА, относится к многоосновным карбоновым кислотам, но отличается более высоким сродством ко многим тяжелым металлам. По данным многочисленных исследований на животных, по эффективности ДТПА не отличается от ЭДТА. Благодаря большему сродству к металлам ДТПА пытались применять при отравлениях тяжелыми металлами (особенно радиоактивными), не поддающихся лечению ЭДТА. К сожалению, эти попытки не имели особого успеха, возможно, потому, что ДТПА не проникает во внутриклеточные депо тяжелых металлов. ДТПА легко связывается с кальцием, поэтому ее используют в виде кальциево-тринатриевой соли. Применение ДТПА пока ограничено рамками клинических испытаний. Во время Второй мировой войны предпринимались многочисленные попытки разработать антидот люизита — содержащего мышьяк боевого отравляющего вещества кожно-нарывного действия. Поскольку мышьяк реагирует с сульфгидрильными группами, Стокен и Томпсон из Оксфордского университета стали систематически изучать тиолы, пытаясь обнаружить вещество, которое конкурировало бы с эндогенными лигандами за связывание с мышьяком. Оказалось, что мышьяк образует очень устойчивый и малотоксичный хелатный комплекс с димеркапролом — соединением, содержащим две сульфгидрильные группы (2,3-димеркаптопропанол). Присоединившиеся к исследованиям своих английских коллег американские ученые назвали димеркапрол британским антилюизитом. Фармакологические исследования показали, что димеркапрол эффективен и при отравлениях тяжелыми металлами. Химические свойства. Структурная формула димеркапрола следующая: Димеркапрол — маслянистая жидкость со свойственным ти-олам резким, неприятным запахом. Поскольку водные растворы этого соединения неустойчивы, используется раствор димеркапрола в арахисовом масле. Димеркапрол и родственные ему тиолы легко окисляются. Фармакологические эффекты димеркапрола обусловлены формированием координационных связей между его сульфгидрильными группами и ионами металла. Эффективность лечения в значительной мере зависит от химических свойств образующихся хелатных комплексов. Выведение токсичных веществ (ртуть, золото, мышьяк) усиливается только в том случае, если эти комплексы стабильны. Однако in vivo комплекс димеркапрол—металл может диссоциировать, а сам димеркапрол — окисляться. К тому же в кислой среде канальцевой жидкости связь между серой и металлом становится неустойчивой, диссоциация хелатных комплексов усиливается, и высвободившийся металл оказывает токсическое действие на почки. Более стабильны хелатные комплексы, в которых две молекулы димеркапрола связаны с одним ионом металла. Следовательно, концентрация препарата в плазме должна быть достаточной для образования таких комплексов и их быстрого выведения, но не чрезмерно высокой, так как димеркапролу свойственны дозозависимые побочные эффекты. Поэтому дозу димеркапрола вводят дробно, следя за экскрецией токсичного металла. Терапию димеркапролом нужно начинать как можно раньше, так как предотвратить с его помощью ингибирование содержащих сульфгидрильные группы ферментов легче, чем реактивировать эти ферменты. Димеркапрол служит антидотом веществ, которые реагируют с сульфгидрильными группами эндогенных лигандов, в первую очередь мышьяка, золота и ртути. Кроме того, в сочетании с кальциево-динатриевой солью ЭДТА препарат применяют при свинцовом отравлении, особенно при свинцовой энцефалопатии. При отравлении селенитами, которые окисляют ферменты, содержащие сульфгидрильные группы, димеркапрол неэффективен. Димеркапрол применяют только в/м. Препарат вводят глубоко в мышцу в виде раствора в арахисовом масле (100 мг/мл), поэтому при аллергии к арахису димеркапрол противопоказан. Максимальная концентрация в крови достигается через 30—60 мин. Препарат быстро элиминируется; его метаболизм и выведение почти полностью завершаются в течение 4 ч. Димеркапрол вызывает разнообразные побочные эффекты, но большинство из них скорее неприятны, чем опасны. У больных, получающих препарат в дозе 5 мг/кг, их частота составляет примерно 50%. Если интервал между инъекциями не меньше 4 ч, кумулятивного действия не наблюдается. Один из самых распространенных побочных эффектов — увеличение систолического и диастолического АД, сопровождающееся тахикардией. При повторном введении в дозе 5 мг/кг с интервалом 2 ч АД может повыситься на 50 мм рт. ст. АД повышается сразу после инъекции и возвращается к норме в течение 2 ч. К другим побочным эффектам относятся (в порядке убывания частоты) тошнота и рвота; головная боль; чувство жжения на губах, во рту и в горле; ощущение сжатия, а иногда и боли в горле, груди и руках; конъюнктивит, блефароспазм, слезотечение, насморк и слюнотечение; покалывание в кистях; жжение в области полового члена; потливость лба, ладоней и других частей тела; боль в животе; болезненный асептический абсцесс в месте инъекции. Перечисленные симптомы часто сопровождаются тревогой и беспокойством. Многие из побочных эффектов возникают одновременно с артериальной гипертонией, а их выраженность соответствует степени повышения АД- Поскольку комплекс димеркапрола с металлом в кислой среде легко диссоциирует, для предотвращения токсического действия металла на почки во время лечения ощелачивают мочу. У детей помимо указанных побочных эффектов возможны лихорадка (в 30% случаев), исчезающая после отмены препарата. Возможно преходящее уменьшение числа нейтрофилов. У больных с недостаточностью Г-6-ФД димеркапрол может вызвать гемолитическую анемию. При печеночной недостаточности препарат противопоказан, за исключением тех случаев, когда она обусловлена отравлением мышьяком. Сукцимер (2,3-димеркаптоянтарная кислота) — недавно разработанное комплексобразующее средство для приема внутрь. По химической структуре он близок к димеркапролу, но содержит две карбоксильные группы, которые влияют на распределение препарата и его способность образовывать комплексы с теми или иными веществами. Структурная формула сукцимера следующая: Сукцимер взаимодействует с цистеином, образуя смешанный дисульфид (Aposhian and Aposhian, 1990): Сукцимер усиливает выведение свинца с мочой, вследствие чего снижается концентрация металла в крови и исчезают вызванные свинцовым отравлением биохимические нарушения, в частности нормализуется активность аминолевулинатдегидратазы(Grazianoetal. 1992). Кроме того, комплекс сукцимера со свинцом выводится с желчью и подвергается кишечно-печеночному кругообороту. Преимущество сукцимера в том, что он почти не повышает экскрецию микроэлементов, таких, как цинк, медь и железо. По данным экспериментов на животных, сукцимер эффективен при отравлениях кадмием, ртутью, другими металлами, а также мышьяком (Aposhian and Aposhian, 1990). Сукцимер менее токсичен, чем димеркапрол, вероятно, благодаря меньшей растворимости в липидах, препятствующей его проникновению в клетки. Тем не менее при лечении сукцимером наблюдается преходящее повышение активности печеночных ферментов в сыворотке. Наиболее распространенные побочные эффекты — тошнота, рвота, понос и снижение аппетита. Возможна сыпь, которая иногда требует прекращения приема препарата. В США сукцимер разрешено применять у детей с концентрацией свинца в крови выше 45 мкг%. Пеницилламин был впервые выделен в 1953 г. из мочи больных с поражением печени, получавших пенициллин. После того как было обнаружено, что пеницилламин способен образовывать хелатные комплексы, его стали использовать для лечения болезни Вильсона и отравлений тяжелыми металлами. Структурная формула пеницилламина (3,3-диметилцистеина) следующая: В клинической практике применяют d-пеницилламин, хотя l-пеницилламин тоже образует хелатные комплексы. Пеницилламин связывает медь, ртуть, цинк и свинец и усиливает выведение этих металлов с мочой. Несомненное преимущество пеницилламина перед другими комплексобразующими средствами — высокая степень всасывания в ЖКТ (40—70%). При приеме пищи, антацидных средств и препаратов железа всасывание пеницилламина ухудшается. Максимальная концентрация в крови достигается через 1—3 ч после приема (Netteret al. 1987). В отличие от своего неме-тилированного предшественника, цистеина, пеницилламин в меньшей степени подвержен действию цистатионин-у-лиазы и оксидазы L-аминокислот и потому относительно устойчив in vivo. При отравлении ртутью N-аце-тилпеницилламин эффективнее пеницилламина (Apos-hian and Aposhian, 1959), возможно, благодаря еще большей устойчивости к действию ферментов. Основной путь элиминации пеницилламина — печеночный метаболизм; в неизмененном виде выводится лишь незначительное количество препарата. Продукты метаболизма пеницилламина обнаруживают как в моче, так и в кале (Perrett, 1981). Пеницилламин выпускают в таблетках и капсулах. Стандартные дозы для взрослых — 1—1,5 г/сут в 4 приема (см. разделы, посвященные отдельным металлам). Препарат следует принимать натощак, чтобы избежать взаимодействия с металлами, содержащимися в пище. Помимо отравлений медью, ртутью и свинцом пеницилламин используют при болезни Вильсона (гепатолентикулярная дегенерация), цистинурии и ревматоидном артрите. При болезни Вильсона пеницилламин, как правило, назначают в дозе 1—2 г/сут в 4 приема. Чтобы убедиться, что доза пеницилламина достаточна, следят за экскрецией меди. Пеницилламин вступает в реакцию тиол-дисульфид-ного обмена с малорастворимым цистеином с образованием более растворимого смешанного дисульфида. Благодаря этому свойству препарат применяют при цистинурии. Стандартная доза — 2 г/сут в 4 приема; при необходимости дозу изменяют, ориентируясь на экскрецию цистина с мочой. Механизм действия пеницилламина при ревматоидном артрите остается неясным. Возможно, терапевтический эффект обусловлен выраженным уменьшением концентрации ревматоидного фактора, представленного аутоантителами IgM (Wernick et al. 1983). Примечательно, что уровень других иммуноглобулинов в сыворотке при этом не снижается. Предлагались разные схемы лечения ревматоидного артрита пеницилламином. Начальная доза обычно составляет 125—250 мг 1 раз в сутки. При необходимости каждые 1—3 мес дозу увеличивают. До наступления заметного улучшения может пройти 2—3 мес. Во многих случаях эффект достигается при использовании доз, не превышающих 500—750 мг/сут. Предпринимались попытки применять пеницилламин при первичном билиарном циррозе печени и системной склеродермии. Терапевтический эффект препарата при этих заболеваниях, возможно, тоже обусловлен уменьшением концентрации иммуноглобулинов и иммунных комплексов (Epstein et al. 1979). Основной побочный эффект кратковременной терапии пеницилламином — аллергические реакции, особенно при аллергии к пенициллинам (Bell and Graziano,1983). Риск аллергических реакций, обусловленных примесью пенициллина, сведен к нулю, так как современные препараты пеницилламина не содержат пенициллин. При длительном приеме пеницилламин вызывает поражения кожи, как легкие (сухость и шелушение), так и более выраженные (крапивница, пятнистая, папулезная или буллезная сыпь, волчаночный синдром, дерматомиозит). Кроме того, пеницилламин нарушает образование коллагена. Наблюдающаяся у трети больных крапивница или пятнисто-папулезная сыпь, сопровождающиеся отеком, зудом и лихорадкой, может быть следствием перекрестной реакции с пенициллинами (Bell and Graziano, 1983). Подробно поражения кожи, вызванные пеницилламином, описаны в работе Levy et al. (1983). Пеницилламин способен вызвать тяжелые гематологические нарушения — лейкопению, эгоистическую анемию и агрануло-цитоз. Эти нарушения могут возникнуть в любые сроки после начала лечения и привести к смерти. Поэтому больные должны находиться под тщательным наблюдением. Пеницилламин вызывает поражение почек, которое может ограничиться обратимыми протеинурией и гематурией или прогрессировать вплоть до развития нефротического синдрома вследствие мембранозной нефропатии. Зарегистрированы редкие случаи смерти от синдрома Гудпасчера (Hill, 1979). Хотя органы дыхания поражаются редко, может развиться облитерирующий бронхиолит, сопровождающийся тяжелой одышкой. Длительный прием пеницилламина вызывает миастению (Gordon and Burnside, 1977). К менее опасным побочным эффектам относятся тошнота, рвота, понос, диспепсия, снижение аппетита, временная утрата вкусовых ощущений (сладкого и соленого). Последняя устраняется добавлением к пище меди. Противопоказания к терапии пеницилламином — беременность, почечная недостаточность, а также обусловленные приемом пеницилламина агранулоцитоз или эгоистическая анемия ванзмнезе. Пеницилламин — препарат выбора при болезни Вильсона. Однако из-за побочных эффектов (см. выше) некоторые больные его не переносят. В таких случаях используют триентин (триэтилентетрамин). Триентин усиливает экскрецию меди, хотя и в меньшей степени, чем пеницилламин. Препарат назначают внутрь в 2—4 приема натощак; максимальная суточная доза для взрослых — 2 г, для детей — 1,5 г. Триентин может вызвать дефицит железа; в этом случае помогает короткий курс лечения препаратами железа. Интервал между приемом триентинаи препаратов железа должен составлять не менее 2 ч. Дефероксамин получают из Streptomyces pilosus в виде хелатного комплекса с железом, а затем химическими методами выделяют в чистом виде. Дефероксамин обладает чрезвычайно высоким сродством к трехвалентному железу (константа ассоциации КА = 1031) при очень низком сродстве к кальцию (КА = 102). По данным исследований in vitro, дефероксамин способен извлекать железо из гемосидерина и ферритина и, в меньшей степени, из трансферрина. Железо, входящее в состав гемоглобина и цитохромов, с помощью этого препарата не выводится. Дефероксамин плохо всасывается в ЖКТ и в большинстве случаев применяется парентерально. При тяжелом отравлении железом (уровень железа в сыворотке выше 500 мкг%) предпочтительно в/в введение. Препарат вводят путем длительной в/в инфузии со скоростью 10-15 мг/кг/ч. Иногда скорость введения увеличивают до 45 мг/кг/ч. Быстрое в/в введение чревато падением дД. При умеренном отравлении (уровень железа в сыворотке 350—500 мкг%) дефероксамин можно применять в/м в дозе 50 мг/кг (максимальная доза — 1 г). Артериальная гипотония возможна и при в/м введении. При гемосидерозе (например, у больных талассемия-ми) дефероксамин рекомендуется вводить в/м в дозе 0.5-1 г/сут. Возможно также п/к и в/в введение. Длительная п/к инфузия в дозе 1—2 г/сут почти столь же эффективна, как и в/в введение (Propper et al. 1977). При переливании крови больным талассемиями дефероксамин вводят путем в/в инфузии со скоростью не более 15 мг/кг/ч через отдельный катетер (по 2 г на каждую дозу перелитой крови). При гемохроматозе дефероксамин не применяют; методом выбора служит кровопускание. Дефероксамин назначают также для связывания алюминия у больных, находящихся на диализе (Swartz, 1985). Дефероксамин метаболизируется в основном ферментами плазмы (хотя пути его метаболизма пока не изучены) и легко выводится с мочой. Препарат вызывает разнообразные аллергические реакции, в том числе крапивницу и анафилактический шок. К другим побочным эффектам относятся болезненное мочеиспускание, неприятные ощущения в животе, понос, лихорадка, мышечные спазмы в ногах, тахикардия. Описаны случаи катаракты. Длительное лечение высокими дозами дефероксамина (при большой талассемии, требующей постоянных переливаний крови) приводит к поражению нервной системы с нарушениями зрения и слуха (Olivieri et al. 1986). В высоких дозах (10—25 мг/кг/ч) препарат вызывает поражение легких (Freedman et al. 1990; Castriota-Scanderbeg et al. 1990), проявляющееся тахипноэ, гипоксемией, лихорадкой и эозинофилией. Противопоказания к лечению дефероксамином — почечная недостаточность и анурия; при беременности препарат назначают только в случае крайней необходимости. В настоящее время проходят испытания деферипрона (1,2-диметил-3-гидроксипиридин-4-он) — антидота железа для приема внутрь. Возможно, этот препарат станет приемлемой альтернативой для больных большой талассемией, которые не хотят или не могут лечиться дефероксамином (Olivieri et al. 1995). Растительные препараты Токсикология Отравление свинцом. Лечение Отравление ртутью. Лечение Отравление мышьяком. Лечение Отравление кадмием. Лечение Антидоты Атмосферные загрязнители воздуха Летучие органические вещества
Тригеволол, Тригексифенидил, Тридекактид, Тридигексетил йодид, Тридигексетила йодид, Тридолгозир, Триентин, Тризоксим, Триклабендазол.
Антидоты тяжелых металлов и железа
Полная информация по препарату Купренил: инструкция, применение, Где можно купить в России (за границей) препарат ТРИЕНТИН и какова его.
Болезнь Вильсона лечится препаратами, которые выводят медь из организма-купренил, триентин или их аналоги. Ответить. Гость 28 Апреля, 2010, 06.
Триентин. Желчегонные. Урсодеоксихолиевая кислота. Пищеварительные ферменты. Ферменты поджелудочной железы. Рвотные. Апоморфин.