







 Рейтинг: 4.0/5.0 (1592 проголосовавших)
Рейтинг: 4.0/5.0 (1592 проголосовавших)Категория: Инструкции
Использование: в вирусологии. Сущность изобретения: предложена безвредная вакцина против болезни Марека с высокой иммуногенной активностью, что достигается использованием штамма ГКВ N 2223. Указанная вакцина используется для профилактики болезни у цыплят суточного возраста. 2 с. п. ф-лы, 3 табл.
Изобретение относится к ветеринарии, в частности ветеринарной вирусологии, и представляет собой способ получения и применения живой вакцины против болезни Марека.
Болезнь Марека регистрируется во всех странах мира, где развито промышленное птицеводство, в том числе и в нашей стране, вызывая большие экономические потери. Болезнь характеризуется образованием единичных (в начальной стадии) и множественных опухолей во внутренних органах, коже, мышцах, а также изменениями центральной и периферической нервной системы. Вирус болезни Марека повреждает иммунокомпетентные органы (селезенку, тимус, клоакальную сумку) и обладает таким образом иммунодепрессивной активностью, чем снижает общую резистентность птиц и повышает чувствительность их к другим болезням. Поэтому болезнь Марека довольно часто протекает в ассоциации с другими заразными заболеваниями.
Репродукция вируса болезни Марека завершается в эпителии перьевых фолликулов, где он содержится в виде зрелых вирионов.
Для специфической профилактики болезни Марека применяют живые вакцины из аттенуированного вируса болезни Марека (штамм НРRS-16), апатогенного вируса (штаммы СVI-988, WHG, VC, BC-I, SB-I) и из герпесвируса индеек (штаммы FC-126, РВ-ТНV-I).
Применяемая в нашей стране вакцина против болезни Марека из вируса герпеса индеек (штамм FС-126) имеет низкую активность против изобретения. Кроме того, следует обратить внимание на факт окончательной репродукции вируса в организме птицы. Вирус герпеса индеек не созревает в эпителии перьевых фолликулов, а следовательно, контактная передача этого вируса практически не существует. Вакцинируют цыплят в суточном возрасте. Напряженный иммунитет при использовании данной вакцины наступает через две недели после вакцинации.
Однако наиболее восприимчивы к естественному заражению цыплята 1-14-суточного возраста. Это приводит к тому, что в наиболее восприимчивом возрасте цыплята остаются незащищенными против болезни.
Целью изобретения является получение высокоиммуногенной, эффективной, безвредной вакцины с высокой степенью защиты цыплят уже через 7 суток после вакцинации, а также обеспечение высокого уровня иммунитета в условиях массового заражения птиц.
Для достижения цели в качестве вакцинного штамма используют штамм "ВНИВИП" вируса болезни Марека, представляющий апатогенный генетически однородный вирусный материал, легко культивируемый в культуре куриных эмбриональных фибробластов с высокой биологической активностью (титр вируса 1 10 5 6 10 5 ФОЕ/см 3 ) и вызывающий напряженный иммунитет по сравнению со штаммом FC-126 у привитой птицы.
Штамм "ВНИВИП" вируса болезни Марека депонирован в государственной коллекции вирусов научно-исследовательского института вирусологии им. Д.И.Ивановского ГКВ N 2223.
Способ изготовления вакцины.
Вакцину готовят следующим образом.
Вакцинный штамм "ВНИВИП" хранят в сосудах Дьюара с жидким азотом (-196 о С). При изготовлении вакцины производят рассев расплодки в культуре куриных эмбриональных фибробластов. Для этого берут 3-7 ампул с вакцинным штаммом вируса (титр которого должен быть не менее 1 10 5 ФОЕ/см 3 ). После извлечения из азота ампулы немедленно помещают в воду с температурой 35-37 о С до полного оттаивания. После оттаивания содержимого ампул горлышки ампул тщательно обтирают спиртом, обжигают и отбивают запаянные концы стерильным корнцангом. Пипеткой аккуратно берут содержимое ампул, объединяют и разводят (или используют без разведения) питательной средой из расчета, чтобы в каждом 1 см 3 содержалось 10 000 ФОЕ. Затем сливают из роллерных флаконов с 24-48-часовой культурой клеток ростовую среду и заменяют ее поддерживающей с 2% сыворотки крупного рогатого скота. В поддерживающую среду вносят вируссодержащую суспензию в количестве 150-200 ФОЕ/см 2 площади флакона. Флаконы с зараженной культурой помещают в роллерную установку со скоростью вращения 8-10 об/ч в термальной комнате (термостате) при температуре 39-40 о С на 3 сут.
К моменту съема клеток типичные фокусные поражения на культуре клеток должны быть отчетливо видны под микроскопом. Поддерживающую среду удаляют осторожно, не допуская смывания клеток со стекла, в сосуды вносят подогретый до 30-37 о С 0,125-0,25%-ный раствор трипсина из расчета 0,07-0,1 см 3 /см 2 площади флакона. Монослой смачивают раствором трипсина 2-3 мин, затем раствор трипсина сливают, флаконы вращают со скоростью до 20 об/мин при комнатной температуре 5-10 мин, после чего в сосуды в тех же объемах вносят поддерживающую питательную среду без сыворотки. Энергичным покачиванием клетки отслаивают от стекла и суспендируют в среде, после чего проводят 2-й пассаж.
С этой целью инфицированными клетками, собранными с одного роллерного флакона заражают свежий монослой из расчета 1:3 1:6, т.е. 3-6 роллерных флаконов и культивируют монослой до съема вируса и проведения 3-го пассажа 48 ч.
Сосуды с клеточными культурами, зараженными вирусом первого пассажа, помещают в роллерные установки в термальной комнате при 39-40 о С.
Характер специфического вирусного поражения монослоя, зараженного вирусом первого пассажа, несколько отличается от поражений, вызываемых вирусом второго пассажа. При культивировании вируса первого пассажа отмечают очаговые (фокусное) поражение монослоя. Вирус второго пассажа поражает гораздо большую часть клеток: в культуре клеток на 50-70% монослоя образуются симпласты и поликариоциты (крупные многоядерные клетки), которые легко можно увидеть под микроскопом.
Сбор клеток, инфицированных вирусом второго пассажа, осуществляется методом, описанным для первого пассажа вируса.
Клеточносвязанным вирусом второго пассажа заражают монослойные культуры клеток (3-й пассаж вируса) из расчета 1:5 1:25 и инкубируют их затем 48-72 ч. Можно заражать из расчета 1:50 1:100 и тогда следует культивировать 72-96 ч. По окончании периода инкубации в термальной комнате при 39-40 о С проводят сбор инфицированных клеток.
С этой целью инфицированные монослои обрабатывают 0,125-0,25% -ным раствором трипсина, также как и при съеме вируса первого пассажа и второго пассажа. После удаления трипсина во флаконы вносят защитную среду (поддерживающая среда с 10% сыворотки крупного рогатого скота и 10% диметилсульфоксида). Объем защитной среды для сбора и суспендирования клеток 0,02-0,04 см 3 /см 2 площади флакона. Собранные суспензии инфицированных клеток объединяют в общем объеме. Концентрация клеток в суспензии должна быть 5-8 млн/см 3 .
Собранную суспензию инфицированных клеток разливают по 1-2 см 3 в предварительно маркированные ампулы, которые закрывают стерильной ватой, запаивают в пламени газовой горелки и помещают в холодильник (2+4 о С) на 40-60 мин. Затем ампулы выдерживают 40-60 мин при (-40) о С, после чего ампулы с вакциной немедленно погружают в жидкий азот.
Приготовленную вакцину контролируют на стерильность по ГОСТ 28085-89 и инфекционную активность путем титрации на 24-часовой культуре куриных эмбриональных фибробластов, выращенных на 50 см 3 флаконах.
С этой целью готовят последовательные десятикратные разведения вируса на питательной среде без сыворотки от 10 -1 до 10 -5. Каждое разведение вируса тщательно пипетируют, не допуская образования пены в пробирке, и по 0,5 см 3 вносят в 3-5 флаконов, предварительно освобожденных от ростовой среды и залитых поддерживающей средой следующего состава: 70% среды Игла, 28% среды 199 и 2% сыворотки крупного рогатого скота. Зараженную культуру инкубируют при 39-40 о С со сменой поддерживающей среды через 24 ч. Через 4-5 сут после заражения клеточные монослои окрашивают амидовым черным. Для этого сливают питательную среду и монослой отмывают от питательной среды 0,5%-ным раствором уксусной кислоты. Затем вносят во флаконы 0,1%-ный раствор амидового черного в 0,5%-ном растворе уксусной кислоты. Прокрашивание фокусов происходит в течение 2-5 мин. Краситель сливают и культуру отмывают от красителя 0,5%-ным раствором уксусной кислоты. Результаты титрования учитывают по наличию точечных окрашенных фокусов.
Подсчитывают фокусы в 3-5 флаконах, соответствующих одному и тому же разведению вируса, в которых число фокусов не превышает 100 и не менее 10.
Титр вируса вычисляют по формуле T где Т титр вируса в ФОЕ/см 3 ; А среднее количество фокусов во флаконе; Р разведение вируса; 2 коэффициент пересчета на 1 см 3 .
Титр вируса в вакцине должен быть не ниже 1 10 5 ФОЕ/см 3. По титру устанавливают количество иммунизирующих доз в 1 см 3. За одну прививную дозу принимают 1000 ФОЕ.
Срок годности вакцины при условии хранения ее в жидком азоте 12 мес.
Вирусвакцина жидкая культуральная применяется с профилактической целью. Вакцинируют цыплят в первые часы после выборки из выводных шкафов непосредственно в инкубатории. Использовать вакцину одновременно с лекарственными препаратами не разрешается.
Перед проведением прививок пеналы с вирусвакциной осторожно вынимают из сосуда Дьюара так, чтобы жидкий азот не разбрызгивался и полностью стекал в сосуд. Затем из пенала, свободного от азота, извлекают необходимое количество ампул и быстро переносят в емкости с водой при 35-37 о С. Пеналы с оставшимися ампулами немедленно погружают обратно в сосуд Дьюара с жидким азотом.
Содержимое каждой ампулы размораживают и растворяют в течение не более 1 мин. Процессу размораживания способствует легкое встряхивание вакцины.
После размораживания ампулы вскрывают и вакцину переносят шприцем во флаконы с разбавителем, соблюдая асептику. Разбавитель при смешивании должен быть охлажден до температуры холодильника 4-8 о С.
Каждую ампулу 2-3 раза ополаскивают разбавителем, который также переносят во флаконы. В каждом флаконе, содержащем 120 см 3 разбавителя, разводят 600 доз, содержащем 160 см 3 800 доз. Флаконы раскрывают и осторожно наклоняют вправо-влево 8-10 раз, не допуская при этом образование пены. Приготовленную вакцину помещают в емкость со льдом и во время прививок флаконы с вакциной периодически легко встряхивают.
При таких условиях вакцина активна в течение 15-20 мин. Разведенную вакцину в дозе 1000 ФОЕ/0,2 см 3 вводят цыплятам внутримышечно в верхнюю треть бедра при помощи инъектора полуавтоматического ИП-1 или ИП-2, или шприцем объемом 1 см 3. Шприцы и иглы перед использованием стерилизуют кипячением в дистиллированной воде в течение 10-15 мин.
П р и м е р 1. Эффективность вакцины из штамма "ВНИВИП" при введении цыплятам различных доз.
Опыты проведения на суточных цыплятах с использованием вакцины из штамма "ВНИВИП" с активностью не ниже 1 10 5 ФОЕ/см 3. Предварительно были приготовлены разведения вируса от 100 ФОЕ/0,2 см 3 до 2000 ФОЕ/0,2 см 3 и каждым его разведением были иммунизированы по 70 голов суточных цыплят. Вакцину вводили внутримышечно в объеме 0,2 см 3 .
В контроле использовали 70 невакцинированных суточных цыплят. Через 14 сут после вакцинации опытные и контрольную группу цыплят заражали внутрибрюшинно вирулентным штаммом "ЗК" вируса болезни Марека. За опытной птицей вели наблюдения в течение 150 сут. Иммуногенность вакцины оценивали по количеству случаев болезни Марека, установленных патологоанатомически или гистологически у павших и убитых по окончании опыта птиц.
Эффективность вакцинации учитывали по формуле Э 100 где Э эффективность вакцинации; А количество случаев болезни Марека в контрольной группе, В количество случаев болезни Марека в опытной группе, Результаты опытов приведены в табл.1.
Из данных таблицы следует, что 100%-ный иммунитет создается при использовании вакцины цыплятам в дозе 1000 ФОЕ/0,2 см 3 .
П p и м е p 2. Сравнительная оценка эффективности разных вакцин.
В опытах использованы вакцины производства Франции, Индии, ФРГ, ГДР, СССР и опытные образцы вакцины из штамма "ВНИВИП".
Изучение эффективности указанных вакцин проводили на суточных цыплятах. Для этого было сформировано 9 групп цыплят по 70 голов в каждой. Цыплят с 1 до 8 групп иммунизировали внутримышечно разными вакцинами в дозе 1000 ФОЕ/0,2 см 3 .
Цыплята 9 группы не вакцинировались и использовались в качестве контроля. Оценка эффективности вакцин проводилась по результатам контрольного заражения цыплят всех групп через 14 суток после их вакцинации. Результаты опыта приведены в табл.2.
Результаты контрольного заражения показывают, что наиболее высокую иммуногенную активность обеспечивает вакцина из апатогенного штамма "ВНИВИП" и французские вакцины из штаммов СУI-988 и SB1.
П р и м е р 3. Сроки наступления иммунитета при вакцинации цыплят разными вакцинами.
Для сравнения испытывали две вакцины: опытную вакцину из штамма "ВНИВИП" и вакцину промышленного производства из штамма "ФС-126".
Изучение сроков наступления иммунитета проводили на суточных цыплятах. Для этого было сформировано 11 групп цыплят. Цыплят с 1 по 5 групп вакцинировали опытной вакциной из штамма "ВНИВИП" в дозе 1000 ФОЕ/0,2 см 3. Цыплят с 6 по 10 групп вакцинировали вакциной промышленного производства из штамма "ФС-126" в дозе 1000 ФОЕ/0,2 см 3. Цыплят в 11 группе не вакцинировали и использовали в качестве контроля. Цыплят опытных групп NN 1 и 6, 2 и 7, 3 и 8, 4 и 9, 5 и 10 заражали вирулентным штаммом "ЗК" вируса болезни Марека через 2, 4, 7, 14 и 21 сут. соответственно. Результаты опыта приведены в табл.3.
Результаты опытов показывают, что полноценный иммунитет (сохранность более 80% ) наступает через 7 сут при вакцинации цыплят вакциной из штамма "ВНИВИП", в то время как при использовании вакцины из штамма "ФС-126" иммунитет наступает через 14 сут.
Таким образом, полученные данные свидетельствуют о возможности изготовления вакцины против болезни Марека из апатогенного штамма "ВНИВИП" для специфической профилактики болезни Марека у кур.
Производственные испытания вакцины проводили по решению Главного управления ветеринарии в птицехозяйстве, неблагополучном по болезни Марека и Тверской области РСФСР. Птицу вакцинировали согласно разработанному наставлению по применению вакцины. Было привито 145500 цыплят. Данные опытов приведены в акте производственных испытаний вакцины.
Результаты испытаний показали, что вакцина из штамма "ВНИВИП" снижает отход птицы от болезни Марека, повышает общую сохранность и продуктивность птиц.
Основываясь на результатах лабораторных и производственных опытов по изучению иммуногенных свойств живой вакцины против болезни Марека из апатогенного штамма "ВНИВИП" и ее безвредности, можно заключить, что предлагаемая вакцина обладает высокой иммуногенностью и безвредна и может использоваться в качестве средства специфической профилактики болезни Марека в птицехозяйствах, неблагополучных по данной болезни.
1. Вакцина против болезни Марека, состоящая из инфицированных фибробластов куриных эмбрионов, замороженных в жидком азоте, отличающаяся тем, что она содержит фибробласты, инфицированные штаммом вируса болезни Марека ГКВ N 2223.
2. Способ профилактики болезни Марека, включающий введение цыплятам вакцины, отличающийся тем, что из вакцин используют вакцину из штамма ГКВ N 2223, а введение осуществляют цыплятам суточного возраста в дозе 1000 ФОЕ/0,2 см 3 .
Курс ветеринарной вирусологии
Решение диагностической задачи №11
Болезнь Марека (лат. -- Morbus Marek; англ. -- Mareks Disease; нейролимфатоз птиц, паралич птиц, инфекционный нейролимфатоз птиц, энзоотический нейроэнцефаломиелит птиц, БМ). Впервые болезнь описана в 1907 г. венгерским профессором Й. Мареком как полиневрит. В последующие годы болезнь была зарегистрирована в различных странах под другими названиями (нейролимфатоз, паралич птиц, неврит, инфекционный нейрогрануломатоз и др.). Несколько позже (1926-- 1929 гг.) американские исследователи Паппенгеймер, Дан и Зэйдлин установили, что кроме параличей и парезов у птиц возникают лимфоидные опухоли, сходные с опухолями, развивающимися при лимфоидном лейкозе. Это дало повод к объединению болезни Марека и разных форм лейкоза птиц в так называемый нейролимфоматоз.
В настоящее время доказано, что болезнь Марека и лимфоидный лейкоз различают как с точки зрения патологии, так и в этиологическом отношении.
Заболевание встречается во всех странах, в том числе и в России. Несмотря на 100%-ную вакцинацию птицы, в птицеводческих хозяйствах отмечаются вспышки болезни. В птицеводческих хозяйствах России болезнь Марека занимает одно из первых мест среди инфекционных заболеваний.
Болезнь Марека, являясь одной из наиболее распространенных болезней кур, встречается во всех странах мира. Наличие инфекции подтверждено во всех промышленных стадах птицы, которые были обследованы во всех частях света. До широкого применения вакцины в странах с хорошо развитым промышленным птицеводством из каждых 20 кур одна погибла от болезни Марека. Потери США от этой болезни перед началом применения вакцин составляли около 160 млн долларов в год.
За последние 40 лет после изоляции вируса изменилось вызываемое им заболевание. Со временем инфекция становится все более генерализованной, более острой, тяжелой. Расширяется хозяинный спектр. Основная причина изменения вируса БМ заключается в мутациях специфических вирусных генов, вызывающих изменения времени индукции опухолей, потерю А-АГ, снижение скорости репликации in vitro, снижение цитолитической активности in vivo, потерю способности размножаться в лимфоцитах и т.д. Данная эволюция ВБМ, возможно, является результатом иммунологического пресса, вызванного систематической поголовной вакцинацией цыплят, а также возможной рекомбинацией с другими вирусами.
Систематика герпесвирусов.Герпесвирусы [греч. herpes, ползучее поражение кожи] представлены группой сравнительно крупных ДНК-геномных вирусов диаметром 150-200 нм. Нуклеокапсид герпесвирусов организован по типу кубической симметрии; геном представлен двухнитевой молекулой ДНК, содержащей короткий (18%) и длинный (82%) компоненты. В отличие от прочих одетых вирусов, суперкапсиды герпесвирусов образованы фрагментами ядерных мембран, так как созревание дочерних популяций происходит на внутренней мембране ядер заражений клетки. Суперкапсид герпесвирусов пронизывают гликопротеиновые шипы, образованные белками внутренней ядерной мембраны поражённых клеток. Между нуклеокапсидом и суперкапсидом герпесвирусов расположен покровный слой-тегумен [лат. tegumentum, покрытие], толщина которого варьирует у различных вирусов.
Таблица 1: Систематика герпесвирусов.
Герпесвирусы относительно нестабильны при комнатной температуре, термолабильны и быстро инактивируются растворителями и детергентами.
Герпесвирусы вызывают острые и латентные инфекции, а также обладают определённым онкогенным потенциалом. Доказана роль герпесвирусов в развитии болезней злокачественного роста у животных (например, болезнь Марека у цыплят), а также эпидемиологическая связь с образованием некоторых опухолей у человека. Современная систематика разделяет семейство Herpesviridae на подсемейства Alphaherpesviruses, Betaherpesviruses и Gammaherpesviruses.
* Альфагерпесвирусы проявляют высокую цитопатическую активность и патогенны для большого числа хозяев. Патогенные для человека виды включены в состав родов Simplexvirus (вирусы герпеса 1-го и 2-го типа, вирус В герпеса) и VariceUovims (вирус герпеса 3-го типа).
* Бетагерпесвирусы проявляют менее выраженную цитопатичность и патогенны для более узкого круга хозяев. Патогенные для человека виды включены в состав родов Cytomegalovirus (вирус герпеса 5 типа) и Roseolovirus (вирусы герпеса 6А, 6В и 7 типов).
* Гаммагерпесвирусы также патогенны для небольшой группы хозяев и способны размножаться в лимфоидных клетках. Патогенные для человека виды включены в состав рода Lymphocryptovirus (вирус герпеса 4 типа).
Рис.1: Схема строения герпес-вируса.
2. Условие задачи
Диагностическая задача №11
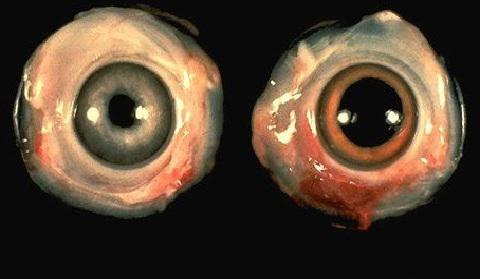
На птицефабрике быстро распространяется заболевание кур всех возрастов. Гибель цыплят 70 - 80%, среди кур - 20-30%. Угнетение, сонливость, затруднение дыхания, кашель, слёзотечение, понос, шаткость походки, парез крыльев и ног.
На вскрытии катаральное воспаление слизистой оболочки глаз, гортани, трахеи, в сердечной мышце - кровоизлияния, слизистая оболочка ЖКТ гиперемирована с кровоизлияниями
3. Этиология заболевания
Впервые болезнь описана в 1907 г. венгерским профессором Й. Мареком как полиневрит. В последующие годы болезнь была зарегистрирована в различных странах под другими названиями (нейролимфатоз, паралич птиц, неврит, инфекционный нейрогрануломатоз и др.). Несколько позже (1926-- 1929 гг.) американские исследователи Паппенгеймер, Дан и Зэйдлин установили, что кроме параличей и парезов у птиц возникают лимфоидные опухоли, сходные с опухолями, развивающимися при лимфоидном лейкозе. Это дало повод к объединению болезни Марека и разных форм лейкоза птиц в так называемый нейролимфоматоз.
В настоящее время доказано, что болезнь Марека и лимфоидный лейкоз различают как с точки зрения патологии, так и в этиологическом отношении. Заболевание встречается во всех странах, в том числе и в России. Несмотря на 100%-ную вакцинацию птицы, в птицеводческих хозяйствах отмечаются вспышки болезни. В птицеводческих хозяйствах России болезнь Марека занимает одно из первых мест среди инфекционных заболеваний.
Возбудитель болезни. Возбудитель относится к семейству Herpesviridae, неклассифицирован в пределах подсемейств, роду Herpesvirus, группы В. Вирус болезни Марека может быть клеточносвязанным и свободным от клеток. Вирусные частицы обнаруживают в ядрах клеток. Антигенная структура вируса сложная. В его основе выделено шесть антигенов, из которых А, В и С считаются наиболее важными. Антиген А содержится как в надосадочной жидкости инфицированной культуры клеток,
так и в экстракте зараженных клеток. Антигены В и С связаны с
зараженными клетками и обнаруживаются только в экстракте
инфицированных клеток. Антиген В является общим для вируса болезни Марека и вируса герпеса индеек, в то время как антигены этих вирусов родственны, но не идентичны. Антигены А и В представляют собой гликопротеиды.
По современной классификации группу вируса болезни Марека подразделяют на три серотипа. К серотипу 1 относят все патогенные вирусы, способные вызывать у цыплят опухолевые поражения. Штаммы серотипа 2 не вызывают опухолевых изменений у цыплят, так как, вероятно, они природно ослаблены. Их используют для приготовления вакцин. Серотип 3 представлен вирусом герпеса индеек. В пере больной птицы и в пыли, взятой из птичника, неблагополучного по заболеванию, вирус остается жизнеспособным при 37 °С в течение 190 дней, при комнатной температуре и температуре бытового холодильника -- 316 дней. В пыли, хранившейся при температуре от -- 12 до 37 °С, вирус сохраняет активность до 459 дней, в перьевых фолликулах -- до 445 дней. При воздействии 3%-ного раствора гидроксида натрия, креолина, лизола, 1%-ного раствора формальдегида, осветленной хлорной извести, содержащей 3 % активного хлора, и других дезинфицирующих средств вирус инактивируется за 20 мин.
лимфоидный лейкоз животное герпесвирус энцефаломиелит
4. Выбор патматериала, методы консервирования
Возбудитель болезни Марека относится к пантропным вирусам: с током крови, лимфы разносится по всем органам и тканям. Для исследования берут: при жизни - кровь, очины вырванных перьев; от трупов - селезёнка, печень, яичник, сердце, лёгкие, фабрицева сумка, тимус и опухолевые образования.
Рис. 2: опухолевый процесс в печени при болезни Марека
Рис. 3: Воспаление бедренного нерва при болезни Марека
Патматериал лучше исследовать в свежем виде, при необходимости проводят консервирование. Методы консервирования:
2. 50 % водный раствор глицерина. Недостаток этого метода - материал нельзя использовать для люминесцентной микроскопии.
3. Консервирование антибиотиками. Используются пенициллин, стрептомицин.
Кроме того, у каждой птицы с наружной поверхности бедра
выщипывают по 10. 15 перьев с наличием производящей ткани (эпителия перьевых фолликулов) внутри очина. Патологический материал используют для вирусологических (не позднее 2. 3 ч после взятия) и патоморфологических исследований. При гистологическом исследовании характерным признаком считают наличие очаговодиффузных, инфильтративногиперпластических процессов в периферических нервах, внутренних органах, поперечнополосатой мускулатуре и коже. Характерным полиморфным составом инфильтратов считают такой, в котором преобладают лимфоидные клетки.
5. Подготовка патматериала для вирусологического исследования
Проводится с целью освобождения вируса из клетки перед проведением вирусологического исследования. Этапы:
1) Освобождение от консерванта части материала. Вторую половину хранят в холодильнике до получения результатов исследования. При консервировании глицерином материал промывают в нескольких порциях стерильного физраствора.
2) Приготовление мазков.
3) Приготовление суспензии. Сначала материал измельчают, затем растирают до получения однородной суспензии в фарфоровых ступках со стерильным кварцевым песком, используют гомогенизаторы или ультразвуковые дезинтеграторы.
4) Центрифугирование суспензии при 1500 оборотов в минуту.
5) Полученную надосадочную жидкость отсасывают в стерильные пробирки.
6) К полученной жидкости добавляют антибиотик и выдерживают 1 час при комнатной температуре. Или проводят фильтрование через стерилизующие азбестовые фильтры.
7) Контроль полученного вируссодержащего материала на загрязнённость: проводится посев на питательные среды. При отсутствии посторонней микрофлоры вируссодержащий материал используется для вирусологического исследования.
6. Методы лабораторной диагностики
Для экспресс-диагностики используют:
2 Обнаружение телец-включений.
Метод флуоресцирующих антител (РИФ)
В основе - взаимодействие специфических антител, меченных флуохромами с антигеном. Для мечения используются флуохромы, которые не изменяют основных свойств антител и их способности взаимодействовать с антигенами. Для постановки используются диагностические люминесцирующие сыворотки, содержащие меченные антитела.
Постановка реакции: 1) Прямой метод. На зафиксированный мазок наносят раствор флуохрома и окрашивают 25 минут при температуре 37 0 С во влажной камере (чашка Петри с фильтровальной бумагой, увлажнённой дистиллированной водой). Промывают водой, обрабатывают в фосфатно-буферном растворе для исключения неспецифического свечения.
2) Непрямой метод. Ставится в 2 варианта: а) с использованием антивидовой люминесцирующей сыворотки. На первом этапе на зафиксированный мазок наносят иммунную нефлуоресцирующую сыворотку с антителами, специфичными к возбудителю. После контакта тщательно промывают препарат. На втором этапе наносят антивидовую люминесцирующую сыворотку со специфичными антителами к глобулинам первой сыворотки. Контакт. Тщательно промывают, высушивают, микроскопируют.
б) с использованием антикомплиментарной люминесцирующей сыворотки. На первом этапе на мазок наносят смесь комплимента и иммунной нефлуоресцирующей сыворотки, содержащей антитела, специфичные предполагаемому возбудителю. Контакт. Препарат промывают. На втором этапе наносят антикомплиментарную люминесцирующую сыворотку. Контакт, промывают, высушивают, микроскопируют.
По Романовскому-Гимзе азур-эозином. На приготовленный мазок наносят азур-эозин и окрашивают 10 минут. Тельца-включения при микроскопии будут фиолетового цвета, так как вирус болезни Марека ДНК-содержащий.
Применяют специальную окраску по Павловскому. Берут истечения из носовой полости, делают мазок, высушивают на воздухе, не фиксируют, на препарат наносят краску Павловского и окрашивают 10 минут, промывают водой, высушивают, микроскопируют. Цитоплазма эпителиальных клеток - бледно-розового цвета, ядро - фиолетового цвета. В ядре красного цвета тельца-включения.
6.2 Вирусологические методы
Herpesvirus удаётся культивировать на однодневных цыплятах; на куриных эмбрионах; на хорионаллантоисной оболочке в виде плотных очагов; в клеточной культуре куриных эмбрионов с образованием микроскопических телец-включений.
Биопроба на цыплятах.
Биопробу на цыплятах проводят с целью определения патогенности возбудителя дифференциации заболевания от некоторых форм гиповитаминозов, лейкоза, а также при экспериментальном изучении болезни Марека.
Цыплят получают из хозяйств, благополучных по инфекционным болезням птиц, где не проводится вакцинация против болезни Марека.
Тридцать однодневных цыплят заражают двукратно с интервалом в 2 дня по 0,3--0,4 мл внутрибрюшинно. В контроле одновременно содержат в аналогичных условиях 10--15 незараженных цыплят такого же возраста.
За птицей ведут ежедневно наблюдение в течение 85--90 дней при диагностике острой, формы болезни Марека и до 120 дней -- классической формы.
Оценку результатов биопробы проводят по комплексу признаков, учитывая клиническое проявление болезни у зараженных цыплят, наличие вирусспецифического антигена в эпителии перьевых фолликулов, специфических микроскопических изменений в тканях (через 3--8 недель), опухолевых поражений в органах и специфических изменений в нервах через 1--4 месяца.
Биопроба на куриных эмбрионах. Для заражения используют куриные эмбрионы из хозяйств, благополучных по инфекционным болезням птиц, где не проводят вакцинацию цыплят против болезни Марека.
В первом варианте заражают 11--12-дневные куриные эмбрионы в хориоаллантоисную оболочку. Эмбрионы, зараженные на хорионаллантоисную оболочку, инкубируют в течение 7--8 дней. Гибель их считают специфической через 72 ч после заражения. При положительной биопробе появляются пустулы и очаги пролиферации. Признаком инфицирования эмбрионов вирусом болезни Марека считают их гибель и образование на хорионаллантоисной оболочке серовато-белых пролиферативных очажков-бляшек размером до 3 мм в диаметре, увеличение селезенки и печени эмбриона. Для учета очажков-бляшек хорионаллантоисную оболочку помещают в чашку Петри, наполненную физиологическим раствором, несколько раз отмывают, расправляют и просматривают с помощью, лупы на титропляторе или под микроскопом.
Микро- и макроскопические бляшки и количество их на оболочке могут варьировать в зависимости от чувствительности куриных эмбрионов к вирусу болезни Марека и вирулентности штамма возбудителя.
Во втором варианте заражают 4-дневные эмбрионы в желточный мешок. В положительных случаях у 30% инфицированных эмбрионов через 12 -- 14 дней на хорионаллантоисной оболочке развиваются пустулы. Гибель зародышей считается специфической с 8--9-го дня инкубации.
Выделение вируса на культуре клеток.
Для выделения вируса болезни Марека из патологического материала используют 24--48-часовую культуру первичнотрипсинизированных куриных фибробластов или 72-часовую культуру почек куриных эмбрионов или цыплят, которых готовят общепринятым методом и выращивают в стеклянных флаконах (матрасах) со смещенным горлом.
В качестве питательной среды для культивирования клеток используют гидролизат лактальбумина, среду Игла или Эрла, или среду № 199. В ростовую среду добавляют 10% сыворотки крупного рогатого скота, в поддерживающую -- 2 %.
Культуру клеток заражают материалом, или 10 %-ной суспензией из клеток почек больной птицы. Суспензию готовят по следующей методике: из почек вырезают кусочки размером 2--3 мм, дважды отмывают раствором Хенкса, вносят в колбу и заливают 0,25 %-ным раствором трипсина в объеме 1. 10, Колбу помещают на магнитную мешалку, суспензию перемешивают в течение 20--30 мин при комнатной температуре. Затем клеточную взвесь фильтруют через 2 слоя марли и центрифугируют при 1 тыс. об/мин в течение 10--15 мин. Осадок ресуспензируют в культуральной питательной среде из расчета, чтобы в 1 мл взвеси было 3--4 млн, клеток. В суспензию добавляют по 1000 ЕД пенициллина и стрептомицина и 40--50 ЕД нистатина на 1 мл суспензии, выдерживают в холодильнике в течение 30--60 мин при температуре 4 °С, после чего используют для заражения. Перед заражением из матраса (флакона) удаляют ростовую среду и на сформированный монослой клеток вносят исследуемый материал в дозе по 3 мл на флакон размером 4X5 см.
После контакта в термостате в течение 30 мин клетки заливают поддерживающей средой и продолжают инкубировать. По мере закисления (изменение цвета среды, величины рН) поддерживающую среду заменяют.
На 7--8-й день проводят второй пассаж вируса. Для этого поддерживающую среду осторожно удаляют, вносят на монослой одного матраса 1--2 мл подогретого до 30--37 °С 0,125 %-ного раствора трипсина и оставляют на контакте при комнатной температуре в течение 2--3 мин. Затем трипсин полностью сливают, а в матрас вносят питательную среду и путем энергичного встряхивания клетки отслаивают от стекла. Полученной суспензией клеток заражают свежий монослой из расчета 1:3, т. е. вирусом, собранным с одного флакона, можно заразить монослой 3 флаконов (из расчета 3--4 млн. вируссодержащих клеток на монослой 1 флакона). После контакта в течение 30 минут клетки заливают поддерживающей средой и продолжают инкубировать 48--72 ч.
Через 6 -- 7 дней проводят третий пассаж вируса по такой же методике.
Учет результатов пассажей ведут по характеру цитопатогенного действия (ЦПД) вируса, имея в виду, что вирус болезни Марека вызывает цитопатические изменения монослоя в виде фокусов, состоящих из скопления округлых рефрактильных клеток, синцитиев и микроскопически видимых бляшек -- негативных пятен.
Сроки наступления ЦПД зависят от дозы вируса и количества пассажей. При первичном выделении возбудителя специфические морфологические изменения клеток обычно проявляются во втором, третьем пассажах вируссодержащего материала через 48--96 ч. Специфичность ЦПД подтверждается путем исследования отдельных проб материала в РДП.
В качестве антигена для РДП используется культуральная жидкость, сконцентрированная в 20--50 раз диализом против глицерина или сахарозы в целлофановых мешочках.
Сроки установления диагноза.
По данным лабораторного исследования, диагноз на болезнь Марека ставят через 4 дня по результатам РДП и цитологического метода и через 14 дней -- по результатам гистологического исследования.
Из серологических методов используют РДП для обнаружения в перьевых фолликулах специфического антигена.
От каждой исследуемой птицы с наружной поверхности бедра выщипывают по 15 перьев с наличием производящей ткани (эпителия перьевых фолликулов) внутри очина. Очины пера измельчают ножницами на кусочки по I--2 мм, затем их растирают в ступке или гомогенизаторе. Полученную массу заливают физиологическим раствором 1:10, замораживают и оттаивают, после чего выдерживают сутки при 4 °С. Надосадочную жидкость используют в качестве испытуемого антигена.
Цель: Обнаружение вирусного антигена в эпителии перьевых фолликулов и антител в сыворотке крови в реакции диффузионной преципитации.
1. В РДП исследуют не менее 10 проб сывороток крови птиц и 10 антигенов (проб пера) от цыплят 30--150-дневного возраста и взрослой птицы.
2. РДП ставят в агаровом геле.
3. Компоненты реакции: специфическая преципитирующая сыворотка; контрольная отрицательная сыворотка; специфический антиген; контрольный отрицательный антиген; испытуемый материал.
Перед постановкой реакции агар расплавляют и разливают тонким слоем в чашки Петри или на обезжиренные предметные стекла. В слое застывшего агара при помощи штампа нарезают лунки.
а) Цель: для идентификации антигена в центральные лунки вносят специфическую сыворотку, а в периферические -- испытуемый антиген.
Контроли: 1) специфический антиген+специфическая сыворотка; 2) специфический антиген+отрицательная сыворотка.
б) Цель: для выявления антител в сыворотке крови в центральную лунку вносят специфический антиген, а в периферические -- исследуемые сыворотки.
Чашки Петри или предметные стекла помещают во влажную камеру, выдерживают сутки при температуре 37 °С, затем -- сутки при комнатной.
Учет реакции. Результаты реакции учитывают предварительно через 24--48 ч и окончательно -- через 72 ч.
Реакцию считают положительной при наличии четко выраженных полос преципитации между лунками с испытуемым антигеном и специфической сывороткой, а также между контрольным положительным антигеном и специфической сывороткой при отрицательном результате с отрицательной сывороткой.
Также антиген обнаруживают в пораженных участках хорионаллантоисной оболочки и в экстраэмбриональной жидкости.
Подготовка для РДП. Собирают пораженные участки хорионаллантоисной оболочки и экстраэмбриональную жидкость. Хорионаллантоисные оболочки растирают в ступке с песком или измельчают в гомогенизаторе, добавляют физиологический раствор в объеме 1:3 и центрифугируют. Надосадочную жидкость соединяют с экстраэмбриональной жидкостью и концентрируют в 20 раз выпариванием в токе воздуха от вентилятора. Полученный концентрат используют в качестве антигена в РДП.
6.3 Ретроспективная диагностика
Ретроспективная диагностика - это исследование парных сывороток крови у переболевших животных по приросту титра антител в серологических реакциях. Эта диагностика не применяется при болезни Марека.
6.4 Дифференциальная диагностика
Болезнь Марека дифференцируют от лимфоидного лейкоза, авитаминозов В, Е, D, инфекционного энцефаломиелита, ньюкасловской болезни, гриппа, листериоза и некоторых отравлений.
Практическое значение имеет дифференциальная диагностика болезни Марека и заболеваний лейкозо-саркомной группы (лимфоидный лейкоз), поскольку они распространены наиболее широко.
Лимфоидный лейкоз -- слабоконтагиозная болезнь, протекает хронически и бессимптомно, вызывает незначительный или умеренный (до 3--5%) отход птицы обычно в возрасте 6--12 месяцев. В отличие от болезни Марека при лимфоидном лейкозе нет макро- и микроскопических изменений в центральной и периферической нервной системах, практически нет лимфоидных опухолей в коже и мышцах, но поражается, как правило, фабрициева сумка. Опухоли развиваются чаще в печени, селезенке и реже в других органах.
Микроскопические изменения в тканях при лейкозе и болезни Марека различаются по характеру клеточных инфильтратов. Характерным полиморфным составом инфильтратов при болезни Марека считают такой, в котором преобладают лимфоидные клетки.
При дифференциации болезни Марека от лимфоидного лейкоза необходимо также учитывать характеристику возбудителей, относящихся к разным таксономическим группам и имеющим различные биологические свойства.
В нашей стране принята схема дифференциальной диагностики болезни Марека, лимфоидного лейкоза и инфекционного энцефаломиелита, прилагаемая к действующей инструкции по борьбе с болезнью Марека.
Таблица 1: Дифференциальная диагностика острой (висцеральной) формы болезни Марека и лимфоидного лейкоза птиц по данным патологоанатомического и гистологического исследований
Характерным диагностическим признаком для болезни Марека считают наличие очагово-диффузных инфильтративно-гиперпластических процессов в периферических нервах, внутренних органах, поперечнополосатой мускулатуре и коже. Характерен полиморфно-клеточный состав инфильтратов, в которых преобладают лимфоидные, в меньшем количестве -- бластные клетки, большое количество недифференцированных крупных опухолевых клеток.
Для дифференциации лейкоза от болезни Марека проводят лабораторную диагностику. Лабораторная диагностика лейкоза птиц основана на выявлении группоспецифического антигена в реакции связывания комплемента.
В этом случае компонентами бактериолитической системы являются: исследуемый вируссодержащий материал; диагностическая сыворотка с заведомо известными антителами; комплемент.
Компоненты гемолитической системы, которая нужна для визуального определения реакции: гемолизин; эритроциты.
Учёт: При положительной реакции: в день постановки и на следующий день жидкость в пробирке мутная красного цвета, на следующий день - осадок из эритроцитов, жидкость над осадком прозрачная.
При отрицательной реакции: в день постановки и на следующий день жидкость прозрачная лаково-красного цвета.
Для прижизненной серологической диагностики компонентами реакции являются: Исследуемая сыворотка с неизвестными антителами; диагностикум; комплемент.
Учёт: При положительной реакции: в день постановки и на следующий день жидкость в пробирке мутная красного цвета, на следующий день - осадок из эритроцитов, жидкость над осадком прозрачная.
7. Специфическая профилактика и терапия
В настоящее время рекомендуются вакцинация против БМ в суточном возрасте и ревакцинация в возрасте между 14-м и 21-м днем. Принимаемый на выращивание молодняк вакцинируют против болезни Марека в суточном возрасте, однократно, непосредственно в инкубатории. Привитую птицу содержат изолированно от птиц других возрастных групп. Иммунитет у привитых цыплят вырабатывается на 21. 28-й день. Вакцинацию птицы проводят одной из перечисленных ниже вакцин:
1) жидкой культуральной вирусвакциной из штамма ФС-126 вируса герпеса индеек; 2) сухой культуральной вирусвакциной из штамма ФС-126 вируса герпеса индеек; 3) жидкой культуральной бивалентной вирусвакциной против болезни Марека из апатогенного штамма ВНИВИП вируса болезни Марека и авирулентного штамма ФС-126 вируса герпеса индеек; 4) сухой вирусвакциной из штамма ВНИИЗЖ для вакцинации бройлеров; 5) жидкой культуральной вирусвакциной из штамма 3004 (серотип 1). Кроме вакцин отечественного производства широко используются зарубежные («TAD Марек», «Керамвак» и др.).
Лечение не разработано.
По всем патологоанатомическим признакам, клинической картине и эпизотологической ситуации видно, что возбудителем является вирус болезни Марека. Эту болезнь удалось дифференцировать от лимфоидного лейкоза по лабораторным методам диагностики - РСК, РДП, РИФ.
Степень выраженности и формы болезни зависят от вирулентности вируса и генетически обусловленной породой чувствительности кур. Одни штаммы вируса обладают высокой патогенностью и вызывают острую форму болезни Марека, другие -- менее патогенны и вызывают классическую форму, третьи вообще непатогенны. Такие штаммы вируса могут одновременно встречаться в одном хозяйстве.
Herpesvirus удаётся культивировать на однодневных цыплятах; на куриных эмбрионах; на хорионаллантоисной оболочке в виде плотных очагов; в клеточной культуре куриных, эмбрионов с образованием микроскопических телец-включений.
1. Лабораторные исследования в ветеринарии: Вирусные, риккетсиозные, паразитарные болезни: Справочник/под ред. Б. И. Антонова.- М.:Агропромиздат,1987.
2. Инфекционные болезни животных / Б.Ф. Бессарабов, А.А. Вашутин, Е.С. Воронин; Под ред. А.А. Сидорчука. - М. Колосс, 2007
3. Ветеринарная вирусология / В.Н. Сюрин, Р.В. Белоусова, Н.В. Фомина.- 2-е изд. перераб. и доп..- М.:Агропромиздат 1991
4. Алтухов Н.Н. Краткий справочник ветеринарного врача Москва: Агропромиздат, 1990
5. Справочник ветеринарного врача/ А.Ф. Кузнецов. - Москва: «Лань», 2002. 896с.
6. Справочник ветеринарного врача/ П.П. Достоевский, Н.А. Судаков, В.А. Атамась и др. - М. Агропромиздат, 1990. - 784с.
7. Гавриш В.Г. Справочник ветеринарного врача, 4 изд. Колосс, 2007
Размещено на Allbest.ru